400-640-8558

ALevel化学课程知识点解读:赫斯定律是什么?
文章发布时间:2024-02-27 17:06:10文章来源:考而思在线阅读量:962
赫斯定律是什么?赫斯定律是ALevel化学课程学习和考试的重要知识点之一,因此复习赫斯定律并将其运用于计算提供数据的反应中的焓变,理解为什么标准数据用于这类型的计算是必要的。下面Alevel课程辅导老师为大家解读一下ALevel化学课程知识点中关于赫斯定律的介绍,希望能够帮助大家更好的开展考试复习。
ALevel化学课程知识点解读:赫斯定律
赫斯定律(Hess's law)又叫反应热加成性定律(the law of additivity of reaction heat):若一反应为二个反应式的代数和时,其反应热为此二反应热的代数和。也可表达为在条件不变的情况下,化学反应的热效应只与起始和终了状态有关,与变化途径无关。它是由俄国化学家Germain Hess发现并用于描述物质的热含量和能量变化与其反应路径无关,因而被称为赫斯定律。
在ALevel化学课程的第六章节初始,同学们会接触到一个概念叫“焓”(Enthalpy),它指的是一份物质所具有的能量,用焓=内能+压强*体积来表示。然而对于焓的理解是比较抽象的,但理解焓的差值“焓变”就容易多了。
很多化学反应,在反应前后会有温度变化,例如木炭燃烧、硝酸铵结冰等。这就代表了吸热或放热反应中的能量得失。这部分能量就称之为“焓变”。例如在室外燃烧一小块炭生成CO2放出10kJ热量,那么这部分能量就用∆H来表示,代表燃烧过程中逸散到空气中的热量。反应产生的能量变化可以是不同形式的,包括热量、光、体积变化等等,但这些能量的变化,都可以称之为“焓变”。
焓变也有不同的形式,例如反应焓、形成焓、燃烧焓、中和焓和原子化焓等,这些焓有些是可以实际测量的,也有些是为了计算而虚构的,实际反应可能并不存在。
那么在引入了焓的概念以及各类焓的定义之后,就来看看他在题目里是怎么应用的吧。在此之前,同学们需要理解Hess’s Law是如何运用的。

对于一个化学反应,总能量变化是一定的,无论经过几步反应,或者经过什么反应路径,甚至是虚构的中间步骤。类似于物理或者数学中的向量,无论你经过几个(连续的)步骤,只要起点和终点是相同的,向量和也就相同。
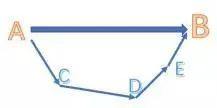
以上就是关于“ALevel化学课程知识点解读:赫斯定律是什么”的详细介绍,同学们是否已经对赫斯定律有了更多的了解呢?如果同学们对于赫斯定律、或其他ALevel化学课程知识点还有疑问,随时都可以咨询考而思在线A-level化学课程辅导专家哦!
当前文章链接:
凡来源标注“考而思在线”均为考而思在线原创文章,版权均属考而思在线所有,任何媒体、网站或个人不得转载,否则追究法律
定制课程
电话咨询
客服微信

在线客服










